Diacids (2) Dicarboxylacids (n=0-3); (n=4-5)
1 YKSINKERTAISET DIKARBOKSYYLIHAPOT
(engl. Simple forms of dicarboxylic acids)
(n= 0-3) Näitä ei lueta lipideihin. Vesiliukoisia.
OKSAALIHAPPO, oxalic acid, oxalate ( n=2)
MALONIHAPPO, malonic acid, malonate (n=3)
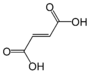
MERIPIHKAHAPPO, succinic acid , succinate (n= 4)
GLUTAARIHAPPO, glutaric acid, glutarate
(n= 5)
Lyhytketjuiset dikarboksyylihapot ovat yleisessä aineenvaihdunnassa hyvin tärkeitä eikä niitä voida katsoa lipideiksi, koska niiden vesiliukoisuus on se tärkeä piirre niissä.
Isommat luetaan lipideihin.ADIPAATTI, PIMELINAATTI
- ADIPIINIHAPPO (Adipic acid) (hexanedioic acid) (n=6) Heksaanidihappo , Butaanidikarboksyylihappo
uusi suomalainen wikipediateksti : https://fi.wikipedia.org/wiki/Adipiinihappo
Adiipiinihappo on kaksiemäksinen karboksyylihappo eli dikarboksyylihappo, joka on normaaliolosuhteissa olomuodoltaan kiinteää, hajutonta, väritöntä, kiteistä jauhetta. Sen kemiallinen kaava on C6H10O4 ja rakennekaava HOOC(CH2)4COOH. Adipiinihaposta käytetään myös nimityksiä heksaanidihappo ja 1,4-butaanidikarboksyylihappo.
Adipiinihapon
moolimassa on 146,14 g/mol,
sulamispiste 152 °C,
kiehumispiste 338 °C, suhteellinen
tiheys 1,36 g/cm
3 (vesi = 1,0 g/cm
3),
leimahduspiste 196 °C (c.c.),
itsesyttymislämpötila 422 °C ja
CAS-numero 124-04-9. Adipiinihapon liukoisuus veteen (15 °C) on 1,4 g/100 ml.
Adipiinihappoa käytetään muovien, tekokuitujen (etenkin
nailon 66:n valmistukseen), pehmittimien ja hajusteiden valmistukseen. Ainetta käytetään
elintarvikkeissa E-koodilla
E355 happamuudensäätöaineena. Elintarvikkeissa adipiinihappo vahvistaa
hapettumisenestoaineiden vaikutusta. Sitä saa käyttää vain joihinkin
jälkiruokiin, kuten kakkujen täytteisiin ja koristeisiin sekä
juomajauheisiin. Adipiinihapon enimmäismäärärajoitus eli
ADI-arvo on 5 mg/kg/vrk.
Adipiinihappo on luonnossa esiintyvä orgaaninen happo ja sitä on mm.
punajuurimehussa. Adipiinihappoa valmistetaan myös kemiallisesti.
Ympäristö- ja terveysvaikutukset
Aine hajoaa kuumentuessaan, jolloin muodostuu
valeriaanahapon (C
5H
10O
2 / CH
3(CH
2)
3COOH) ja muiden aineiden myrkyllisiä ja syövyttäviä höyryjä.
Adipiinihappo ärsyttää silmiä, ihoa ja hengitysteitä. Toistuva tai pitkäaikainen hengitysteitse altistuminen voi aiheuttaa
astman.
" (Teksti tullut nettiin 10.5. 2018)
Oma vanha tekstini, jonka jostain olen löytänyt:
”Vaikka tällä hapolla, joka kantaa latinalaisperäistä nimeä
(adipis = rasva) onkin tällainen nimi, sitä
ei kuitenkaan
esiinny luonnonrasvoissa normaalikomponenttina, vaan se on oksidatiivisen eltaantumisen tuote ( lipidiperoxidaation läpikäynyt,
härskiintynyt siis). Se löydettiin vuonna
1884 risiiniöljystä (castor-oil) typpihapon avulla, kun happo pilkkoi hiiliketjun läheltä OH-ryhmää. Adipiinihappo pystyttiin syntetisoimaan vuonna 1902 tetrametyleenibromidista käsin.
Nykyisin sitä saadaan syklohexanolin tai syklohexaanin oksidaatiolla. Sillä on
paljon teollisia käyttöjä liimautuvien, muovautuvien, gelatinisoivien agenssien tuotossa, hydraulisissa nesteissä, voiteluaineissa, pehmentävissä aineissa tai lisäaineena eräitten nylonlaatujen valmistuksessa ( nylon-6,6), polyuretaanivaahdoissa, nahanparkitsemisessa, uretaanissa ja myös elintarvikkeen happameksi tekijänä. Adipiinihappoa käytetään eri ryhmiin esteröimisen jälkeen, di-kapryyli-, di-etyylihexyyli-, di-isobutyryyli- ja di-isodecyyli ryhmiin esteröityneenä- Graafinen kartta adipiinihapon biosynteesistä omega-oksidaatiolla voi löytyä internetistä. (BioCarta )”
Mutta mitä kertoo amerikkalainen vanhempi biokemia lisää ?
Harper et al. mainitsee organismien adipiinihaposta 1969. Tämän hapon suhteen on tutkittava ravinnossa tulevan
essentiellin aminohapon LYSIININ kataboliaa. Joten nyt täytyy vilkaista
valkuaisen puolelle. Ihmisen keho ei pysty tekemään aminohappoa lysiini (Lys, K) , mutta esim
hiiva pystyy tekemään alfa-glutaraatista ja Acetyl-CoA- molekyylistä käsin homositraattia, joka sitten muuttuu homoaconitaatiksi, homoisositraatiksi, oxaloglutaraatiksi,
alfa-keto-adipaatiksi, alfa-amino-
adipaatiksi, alfa-aminoadipaatti-delta-semialdehydiksi, sitten
saccharopiini- nimiseksi molekyyliksi ja sitten
lysiiniksi. Lysiinin kataboliassa ihmisen kehosta kyllä on todettu sakkaropiinia. Jyrsijäeläimissä ja marsussa on pystytty osoittamaan
katabolisoitumista eteenpäinkin
alfa- aminoadipaatiksi ja keto-adipaatiksi, siis myös ihmisellä. Tästä voi tulla dekarboksylaatiolla glutaraattia, alfa-keto-glutaraattia, glutamaattia tai sitten alfa-kg menee sitruunahapposykliin.
Saccharopiinivaihe todetaan lysiinin kataboliassa
mitokondriaalisesti. On arveltu myös, että L-lysiini katabolisoituu
saccharopiiniksi ja D-lysiini
pipecolaatiksi. Tietysti lysiini voi muuttua hydroxy-lysiiniksi ja siitä OH-pipekolaatiksi.
5-OH-lysiiniä taas esiintyy
kehon kollageenissa ja, (tietysti kollageenituotteissa kuten gelatiinissa ja sorbet- valmisteissa), mutta ehkä se puuttuu muista lämminveristen proteiineista. Pieniä määriä sitä on villassa, trypsiinissä ja Mycobacterium phlei- fosfatidissa. Rotilla tutkittaessa
kollageenin hydroxylysiini on peräisin suoraan ravinnon lysiinistä. Mutta sen sijaan hydroxylysiini (Hyl) syötynä ei mene kollageeniin, vaan perusrakenne täytyy siis syödä lysiini-muodossa, joka on essentielli.
Hydroxylysiini sitten hajoaa alfa-ketoadipaatiksi ja
glutaraatiksi. Mutta nyt on hyvin vähän ollut tietoa 1969-Harperin kirjaan tämän katabolisen reaktion välituotteista. Kuitenkin Harper tiesi, että vaikka 5-OH-D-pipekoolihappo muodostui 5-OH-D-lysiinistä käsin, se muodostui primääristi kuitenkin allo-OH-D-lysiinistä siten että muodostui OH-hydroxy-L-pipekolaattia siitä käsin mieluummin kuin
lysiinin L-isomeeristä, jota esiintyy luonnollisessa kollageenissa. Eräs bakteeri
Achromobacter pystyy muuttamaan kaikki 4 kpl OH-isomeeria 5-OH-pipekolaatiksi.
Koentsyymi joka vaaditaan, että Lys muuttua Hyl muotoon ( hydroxilysiiniksi) on
NADPH ja kupariakin tarvitaan.
MIKSI tästä näin paljon tarinaa?
Osassa maailmaa ravinto on lysiiniköyhää. Proteiineissa essentielli aminohappo lysiini on kuitenkuin hyvin tärkeä. Sen positiivinen aminoryhmäpääty on kohta johon voi kiinnittyä kehon happoja ja siitä voi siirtyä happoa toiseen paikkaan - Tässä muodostuu erilaisia signaloivia teitä haposta. Kts. teksti 20.7. 2018!
---
Lysiinipitoisuus vaikuttaa eräisiin rakenteisiin, kuten aorttaan. Eräissä maissa Afrikassa on esim. aortta ja suurten suonten aneurysmat tavallisia.
Lysiini on viljatuotteissa kriittinen aminohappo, ja muutamissa maissa käytetään hyvin yksipuolisesti viljaproteiiniakin. On koetettu esim kehittää lysiinirikkaampaa maissia. Asia on varmaan hyvin tärkä, koska lysiini (K) on niitä organismien kohtia johon tapahtuu mm epigeneettinen modifikaatio DNA:ssa ja kromoatiinissa, asetylaatiot(Ac) metylaatiot ( me) fosforyalatiot. Toisaatla taas solun
proteiiniaineenvaihdunnassa on ubikitinaatiolla avain osa. Ubikitiinit asetetaan myös K- kohtiin, lysiineihin. Siis varsinainen lysiinin normaali aineenvaihdunta ja sen esentielli saanti ovat aivan perusedellytyksiä ihmisessä.katso kartasta niitä välituoteita joisa on kaksi tai kolme karboksyyliryhmää:
https://www.researchgate.net/figure/Lysine-catabolism-in-mammalian-tissues-The-saccharopine-pathway-indicated-by-A_fig2_234124006
Vanhaa tekstiäni:
Myös
pimele- sana tarkoittaa rasvaa, mutta nyt kreikaksi. Tätäkin on löydetty oksidoituneista rasvoista vuonna 1884 ja tutkimustyössä käytettiin risiinioleiinihappoa , joka oli risiiniöljyperäistä hydroksyloitunutta öljyhappoa (castor oil= risiiniöljy).
Löytyyköhän tästä pimelaatista (pimelate) mainintaa Harperista 1969?
Kyllä vain. Sekin kuulu lysiinin synteesiteihin, kun
bakteerit tuottavat
lysiiniä aspartaatista (Asp, D) ja palorypälehaposta (pyruvic acid) käsin. Aspartaatista ( Asp, D) tulee ensin beeta-aspartyyli-fosfaatti, sitten aspartaatti- beeta-semialdehydi ja tämä kondensoituu palorypälehapon kanssa ja silloin muodostuu 2,3-dihydro-picolinaatti, tästä tulee delta´- tetrahydropicolinaatti, tästä N-succinyl- e-keto-L-alfa-aminopimelaatti, tästä N-succinyl-L,L-alfa, e-diaminopimelaatti, tästä L-alfa, e- diaminopimelaatti, tästä meso- alfa-e- diaminopimelaatti ja tästä ollaan
Lysiinissä. Tämän synteesitien välituotteita bakteerit käyttävät myös soluseinämiensä syntetisoimiseen ja itiöittensä idättämiseen. Mutta pimelaatti esiintyy tässä aminoituneena, joten se on kestävässä muodossa.
Siis arveltavasti nämä adipiinit ja pimeliinit voivat omata hetkellisen struktuurifunktion seinämärakenteissa, adipiini ihmiselläkin.
Muuten - tässä voisi mainita että sellainen ravinto, missä on palkokasveja ja pohjoista viljaa, kuten vehnää, antaa hyvän aminohappoprofiilin, ja edellytykset
lysiinin normaalille aineenvaihdunnalle. Kala on hyvä täydentäjä kollageeni- ja elastiiniraknteille, koska se antaa
haarallisia aminohappoja (BCAA) .
27.2.2009 21:19